Química é a ciência que estuda a estrutura das substâncias, a composição e as propriedades das diferentes matérias, suas transformações e variações de energia.
Ela conquistou um lugar central e essencial em todos os assuntos do conhecimento humano. Relaciona-se com outras ciências como a Biologia, Ciências Ambientais, Física, Medicina e Ciências da Saúde.
A Química é útil em inúmeras atividades, como por exemplo, na agricultura onde os agricultores a utilizam para melhorar a acidez do solo, os médicos precisam do conhecimento químico para reconhecer a composição das substâncias utilizadas como medicamento.
A Química é uma ciência experimental que teve seu processo de descoberta ligado à preocupação que as culturas antigas tinham em compreender a relação entre o ser humano, a natureza e seus fenômenos: a chamada Alquimia.
Água: substância interessante

A água e suas características são curiosas.
A ligação de hidrogênio presente nas moléculas de água faz esta substância possuir propriedades únicas, mas que mistério existe por trás dos átomos de hidrogênio e de oxigênio ligados entre si?
H - 0 - H
Veja algumas das principais características da água:
- Ela se expande quando sua temperatura fica abaixo de 0°C. Uma prova: esta propriedade pode ser vivenciada diariamente, coloque água no freezer e observe sua taxa de expansão, se estiver confinada em recipiente fechado com volume total de água, vai ocorrer uma quebra no recipiente proveniente da dilatação da água.
- Outra característica da água é o seu estado líquido. Mesmo possuindo estrutura molecular parecida com a de outros compostos gasosos, ela insiste em se manter no estado líquido.
A água cobre ¾ da superfície da Terra através de rios, lagos e mares, e se faz presente também em nosso corpo, 70% do peso corporal é correspondente à água, ela é responsável pelo funcionamento dos organismos vivos, regula a temperatura corporal e transporta sais minerais, daí a importância do seu estudo.
Átomos e a construção do Universo
Os átomos se unem para formar moléculas.
De que é feito tudo ao nosso redor? Como se formam os mais variados materiais existentes? O próprio nome já diz: todo material provém da matéria e a matéria é constituída de átomos.
Se for analisar um átomo sozinho em sua estrutura, observaremos os seguintes aspectos: ausência de cor e visibilidade, ou seja, não é perceptível. Mas se aglomeramos uma grande quantidade de átomos surgirão moléculas, e estas irão se unir a mais moléculas para formar outras ainda maiores e diferentes umas das outras. Daí a pouco se tem uma enorme variedade de compostos, e é exatamente assim que se forma tudo em nossa volta.
Mas não pense que foi da noite para o dia que surgiu essa concepção para o átomo. Em tempos remotos a teoria que prevalecia era a dos quatro elementos: terra, fogo, ar e água. Essa era a idéia defendida pelos antigos alquimistas. Com o passar do tempo o átomo foi se revelando e hoje, na era da tecnologia, não podemos desprezar a teoria atômica, até porque o conforto que usufruímos atualmente depende desses princípios, como por exemplo, o forno microondas, a televisão, etc.
Essas e outras tecnologias dependem da existência desta partícula fundamental: o átomo.
Cálculo das partículas atômicas
Sabemos que prótons, elétrons e nêutrons são partículas de um átomo, como saber suas quantidades baseando-se nos dados fornecidos na Tabela Periódica? É preciso então determinar as partículas atômicas baseando-se no número atômico e de massa.Para facilitar nosso estudo é recomendável ter a Tabela em mãos. Observe que os elementos aparecem representados por um símbolo acompanhado do número atômico e número de massa respectivos. A forma esquemática abaixo será utilizada para representar as posições de cada número nos elementos:
ZXA ou AzX
Símbolo do elemento: X
Número de massa: A
Número atômico: Z
As partículas atômicas são representadas assim:
Número de prótons: P
Número de elétrons: e
Número de nêutrons: n
Vale lembrar que:
P = Z P = Z = e A = p + n n = A - Z
Alguns números se relacionam uns com os outros, por exemplo, se você souber o número atômico saberá também o número de prótons e elétrons, pois de acordo com a fórmula (P= Z = e) são iguais. Para determinar o número de nêutrons utilizamos um cálculo baseado na equação n = A – Z.
Vamos colocar o conhecimento em prática? Então defina o número de partículas dos seguintes elementos:
20Ca40
Número atômico → Z = 20
Número de prótons → P = Z = 20
Número de elétrons → P = Z = e = 20
Número de nêutrons → n = A – Z
n = 40 – 20
n = 20
Número de massa → A = P + n
A = 20 +20
A = 40
O Cálcio (Ca) possui: Z = 20, P = 20, e = 20, n = 20 e A = 40. Esses cálculos são aplicados a todos os elementos, para o Flúor (F) temos:
9F19
Os dados da Tabela fornecem Z e A, cálculo de n, e, P:
Número de prótons → P = Z = 9
Número de elétrons → P = e = 9
Número de nêutrons → n = A – Z
n = 19 – 9
n = 10
Só para confirmar o número de massa → A = P + n
A = 9 + 10
A = 19
Como medir a pressão atmosférica?
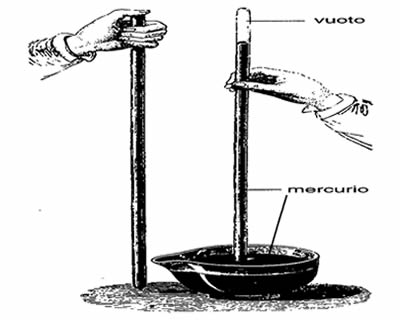
Ilustração de um barômetro.
O ar tem peso? Se você ainda não sabe fica sabendo agora: existe um aparelho específico para medir a pressão que o ar exerce sobre nós. Consiste num tubo capilar de 100 cm de comprimento, fechado em uma das extremidades e que contém mercúrio. Este tubo se encontra imerso em um recipiente que contém mercúrio e recebe o nome Barômetro de Torricelli.
Se não existisse esse aparelho seria necessário fazer inúmeros cálculos até chegar a um resultado não muito confiável. O Barômetro é seguro e eficiente e funciona da seguinte forma: o tubo cheio de mercúrio mostra a pressão, o metal líquido escoa até o ponto de 76 cm, este será o valor de pressão obtido a nível do mar e é considerado o normal, pode ser representado por 760 mmHg ou 1 atmosfera (1 atm).
E quem foi o inventor deste prático aparelho? O cientista italiano chamado Evangelista Torricelli (1608-1647) propôs em 1.643 que a pressão atmosférica podia ser medida através de instrumentos, após muitos estudos surge então o Barômetro de Torricelli, o qual recebeu esta nomenclatura em homenagem a seu inventor.
Então, vamos considerar o seguinte: a pressão atmosférica afeta o peso da coluna de mercúrio no tubo, uma vez que quanto maior a pressão do ar, mais comprida fica a coluna de mercúrio. Como a altura da coluna de mercúrio varia conforme a altitude em que é medida, ocorre que em altitudes elevadas a pressão atmosférica diminui e a altitudes inferiores ela se eleva.
A pressão atmosférica pode ser calculada, multiplicando-se o peso da coluna de mercúrio pela densidade do mercúrio e pela aceleração da gravidade.
Constituição da matéria

A matéria argila é transformada em um
objeto através do trabalho humano.
Podemos definir matéria como sendo tudo aquilo que tem massa e ocupa lugar no espaço. Toda matéria é formada por pequenas partículas, designadas átomos.
Em 1808, se baseando em fatores experimentais, o cientista britânico John Dalton (1766-1844), formulou uma teoria, a chamada teoria atômica de Dalton que define:
1- Pequenas partículas esféricas, maciças e indivisíveis, nomeadas átomos, constituem a matéria.
2- Elemento químico é composto de um conjunto de átomos com as mesmas massas e tamanhos.
3- Elementos químicos diferentes indicam átomos com massas, tamanhos e propriedades diferentes.
4- Substâncias diferentes são resultantes da combinação de átomos de elementos diversos.
5- A origem de novas substâncias está relacionada ao rearranjo dos átomos, uma vez que eles não são criados e nem destruídos.

Modelo atômico de Dalton
São exemplos de matérias o ferro, a madeira, a água, e existem matérias que não podem ser vistas como é o caso do ar que respiramos.
Através da matéria podemos dar origem a materiais (objetos). Exemplificando seria assim: com um pedaço de madeira o carpinteiro faz um móvel, o ferro é usado para fabricar ferramentas.
Surge assim outra definição, a de corpo e objeto: Corpo é qualquer porção limitada de matéria e objeto, é aquilo que o corpo se transforma quando é trabalhado.
Mais exemplos: o escultor usa um pedaço de mármore (corpo) para fazer uma estátua (objeto). O ourives faz um anel (objeto), de uma barra de ouro (corpo).
Ao relacionarmos matéria com o exemplo, ficaria assim:
Matéria- ouro
Corpo- barra de ouro
Objeto- anel
Densidade
Densidade é a relação entre a massa de um material e o volume por ele ocupado. O cálculo da densidade é feito pela seguinte expressão:Densidade = massa
volume
A densidade determina a quantidade de matéria que está presente em uma unidade de volume, por exemplo, o mercúrio possui maior densidade do que o leite, isso significa que num dado volume de mercúrio há mais matéria que em uma mesma quantidade de leite.
A densidade nos auxilia na caracterização de uma substância. A densidade dos sólidos e líquidos é expressa em gramas por centímetro cúbico (g/cm3). Vejamos a densidade de algumas substâncias:
Álcool etílico...........................0,789 g/cm3
Água .......................................0,997 g/cm3
Leite integral............................1,03 g/cm3
Alumínio ................................ 2,70 g/cm3
Diamante ..................................3,5 g/cm3
Chumbo...................................11,3 g/cm3
Mercúrio .................................13,6 g/cm3
Distribuição Eletrônica de Elétrons
Os elétrons estão distribuídos em camadas ao redor do núcleo. Admite-se a existência de 7 camadas eletrônicas, designados pelas letras maiúsculas:
K,L,M,N,O,P e Q. À medida que as camadas se afastam do núcleo, aumenta a energia dos elétrons nelas localizados.
As camadas da eletrosfera representam os níveis de energia da eletrosfera. Assim, as camadas K,L,M,N,O, P e Q constituem os 1º, 2º, 3º, 4º, 5º, 6º e 7º níveis de energia, respectivamente.
Por meio de métodos experimentais, os químicos concluíram que o número máximo de elétrons que cabe em cada camada ou nível de energia é:
| Nível de energia | Camada | Número máximo de elétrons |
| 1º | K | 2 |
| 2º | L | 8 |
| 3º | M | 18 |
| 4º | N | 32 |
| 5º | O | 32 |
| 6º | P | 18 |
| 7º | Q | 2 (alguns autores admitem até 8) |
Em cada camada ou nível de energia, os elétrons se distribuem em subcamadas ou subníveis de energia, representados pelas letras s,p,d,f, em ordem crescente de energia.
O número máximo de elétrons que cabe em cada subcamada, ou subnivel de energia, também foi determinado experimentalmente:
energia crescente
---------------------------------->
| Subnível | s | p | d | f |
| Número máximo de elétrons | 2 | 6 | 10 | 14 |
O número de subníveis que constituem cada nível de energia depende do número máximo de elétrons que cabe em cada nível. Assim, como no 1ºnível cabem no máximo 2 elétrons, esse nível apresenta apenas um subnível s, no qual cabem os 2 elétrons. O subnível s do 1º nível de energia é representado por 1s.
Como no 2º nível cabem no máximo 8 elétrons, o 2º nível é constituído de um subnível s, no qual cabem no máximo 2 elétrons, e um subnível p, no qual cabem no máximo 6 elétrons. Desse modo, o 2º nível é formado de dois subníveis, representados por 2s e 2p, e assim por diante.
Resumindo:
| Nível | Camada | Nº máximo de elétrons | Subníveis conhecidos |
| 1º | K | 2 | 1s |
| 2º | L | 8 | 2s e 2p |
| 3º | M | 18 | 3s, 3p e 3d |
| 4º | N | 32 | 4s, 4p, 4d e 4f |
| 5º | O | 32 | 5s, 5p, 5d e 5f |
| 6º | P | 18 | 6s, 6p e 6d |
| 7º | Q | 2 (alguns autores admitem até 8) | 7s 7p |
Linus Gari Pauling (1901-1994), químico americano, elaborou um dispositivo prático que permite colocar todos os subníveis de energia conhecidos em ordem crescente de energia. É o processo das diagonais, denominado diagrama de Pauling, representado a seguir. A ordem crescente de energia dos subníveis é a ordem na seqüência das diagonais.
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d
--------------------------------------------------------------------->
ordem crescente de energia
Acompanhe os exemplos de distribuição eletrônica:
1 - Distribuir os elétrons do átomo normal de manganês (Z=25) em ordem de camada.
Solução:
Se Z=25 isto significa que no átomo normal de manganês há 25 elétrons. Aplicando o diagrama de Pauling, teremos:
K - 1s2
L - 2s2 2p6
M - 3s2 3p6 3d5
N - 4s2 4p 4d 4f
O - 5s 5p 5d 5f
P - 6s 6p 6d
Q - 7s 7p
Resposta: K=2; L=8; M=13; N=2
2 - Distribuir os elétrons do átomo normal de xenônio (Z=54) em ordem de camada.
Solução:
K - 1s2
L - 2s2 2p6
M- 3s2 3p6 3d10
N- 4s2 4p6 4d10 4f
O- 5s2 5p6 5d 5f
P- 6s 6p 6d
Q- 7s 7p
Resposta: K=2; L=8; M=18; N=18; O=8
Há alguns elementos químicos cuja distribuição eletrônica não “bate” com o diagrama de Pauling.
Energia

Energia Eólica
O nosso universo é constituído de matéria e energia. Se pegarmos qualquer porção do universo e nos submetermos a observá-la, ela pode ser considerada como um sistema, e tudo que rodeia essa porção é denominado ambiente. Sendo assim, podemos classificar o sistema segundo sua capacidade de trocar matéria e energia com o ambiente que está inserido.
Sistema fechado: troca somente energia com o ambiente.
Sistema aberto: tem a capacidade de trocar energia e matéria com o ambiente.
Sistema isolado: nesse sistema não há troca de energia e nem de matéria com o ambiente.
A energia elétrica é a forma de energia mais utilizada no mundo. Ela pode ser obtida de várias maneiras:
Energia solar: é um método que não produz danos ao meio ambiente, sua fonte, o Sol, é inesgotável. Os painéis solares possuem células fotoelétricas que transformam a energia proveniente dos raios solares em energia elétrica.
Energia nuclear: produzida nas usinas nucleares por meio de processos físico-químicos, é uma energia térmica que é transformada em energia elétrica.
Energia eólica: (ar em movimento): é usada para produzir energia elétrica. É atraente por não causar danos ambientais e ter custo de produção baixo em relação a outras fontes alternativas de energia.
A energia elétrica também pode se transformar em:
Energia térmica: quando vamos tomar banho, ao ligar o chuveiro a energia elétrica é transformada em energia térmica.
Energia luminosa: recebemos iluminação em casa pela transformação da energia elétrica que, ao passar por uma lâmpada, torna-se incandescente.
Alotropia
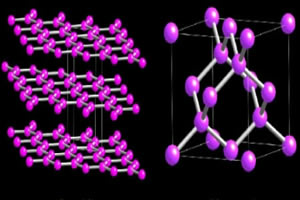
Moléculas de grafite e diamante respectivamente.
Exemplos:
1- O gás oxigênio (O2) e ozônio (O3) diferem um do outro na atomicidade, isto é, no número de átomos que forma a molécula.
Dizemos então que o gás oxigênio e o ozônio são as formas alotrópicas do elemento químico oxigênio. O oxigênio existe no ar atmosférico, sendo um gás indispensável à nossa respiração. O ozônio é um gás que envolve a atmosfera terrestre, protegendo-nos dos raios ultravioleta do sol.
2 - Carbono (C): Seus átomos podem se unir de várias formas diferentes formando inúmeras substâncias. O diamante e a grafite são substâncias simples formadas apenas por carbono, a grande diferença entre elas é a maneira como os átomos ficam organizados nas moléculas, ou seja, o rearranjo dos átomos. A grafite representa a forma mais estável do carbono, já o diamante, só é conseguido com pressões e temperaturas altíssimas.
3 - O fósforo vermelho e o fósforo branco são alótropos do elemento químico fósforo, que diferem entre si pela atomicidade.
OBS: ALOTROPIA refere-se somente a SUBSTÂNCIAS SIMPLES.
Balanceamento de equações

A fotossíntese ocorre em equilíbrio na natureza.
Segundo o cientista francês, Antoine Laurent Lavoisier, em uma reação química: “A soma das massas das substâncias reagentes é igual à soma das massas dos produtos da reação.”
Esse enunciado é conhecido como Lei de Lavoisier ou Lei da Conservação das Massas. Para que uma reação química esteja de acordo com a Lei de Lavoisier, os números de átomos dos elementos devem ser iguais nos dois membros da equação, ou seja, a equação deve estar corretamente balanceada.
Exemplo de um balanceamento - Equação da Fotossíntese:
A fotossíntese é o processo através do qual as plantas, e alguns outros organismos transformam energia luminosa em energia química processando o dióxido de carbono (CO2), água (H2O) e minerais em compostos orgânicos e produzindo oxigênio gasoso (O2). A equação geral do processo:
12 H20 + 6 CO2 -----> C6H12O6 + 6 H20 +6 O2
Quando um vegetal clorofilado realiza fotossíntese, para cada 6 moléculas de gás carbônico que reagem, são necessárias 6 moléculas de água para produzirem 1 molécula de glicose e 6 de oxigênio.
Se um dos coeficientes da equação for multiplicado por um número, todos os coeficientes dessa equação deverão ser multiplicados pelo mesmo número. Verifique o número de átomos, de cada elemento no 1º e 2º membros da equação acima:
C: 6 átomos no 1º membro e 6 átomos no 2º membro.
O: 24 átomos no 1º membro e 24 átomos no 2º membro.
H: 24 átomos no 1º membro e 24 átomos no 2º membro.
Isto significa que a equação acima está corretamente balanceada, ou seja, os seus coeficientes estão ajustados.
Para contar o número de átomos de cada elemento, deve-se multiplicar o coeficiente pelo correspondente índice (número que fica abaixo e à direita do símbolo). Se o elemento aparece em mais de uma substância do mesmo membro, seus átomos devem ser somados.
Classificação da matéria
O sangue é uma mistura heterogênea.
A matéria pode ser definida como sendo tudo aquilo que tem massa e ocupa lugar no espaço, ela é formada por pequenas partículas, designadas átomos e esses podem se unir de várias maneiras, formando as moléculas.
A matéria pode se agrupar através dos átomos e formar os mais variados produtos que se classificam em: substâncias ou misturas.
As substâncias se diferem em dois tipos, de acordo com suas composições:
Substâncias simples: essas apresentam apenas um elemento, ou seja, apenas um tipo de átomo que pode estar agrupado em moléculas ou isolado.
Exemplos: Hidrogênio (H2) e Hélio (He). Repare que o nome da substância simples pode ser o mesmo do elemento que a constitui ou pode ser diferente, como é o caso do Gás Ozônio (O3).
Substâncias compostas: também chamadas de compostos, essas substâncias são formadas por mais de um elemento químico.
Exemplos: Água (H20), Gás cianídrico (HCN), Gás carbônico (CO2), Amônia (NH3).
Observação importante: A substância pura é aquela que apresenta apenas um tipo de molécula, seja ela simples ou composta. Exemplificando ficaria assim:
Oxigênio (O2) - substância pura simples
Metano (CH4) – substância pura composta
Misturas: quando a molécula apresenta mais de uma substância é chamada de mistura. A água oxigenada é um exemplo, pois ela contém água (H2O) e peróxido de hidrogênio (H2O2). As misturas podem se classificar em Misturas homogêneas ou heterogêneas.
Antes de prosseguir é preciso saber: o que é fase? É quando observamos uma determinada mistura a olho nu e vemos apenas um aspecto uniforme de cada fração.
Se, por exemplo, forem colocados em um recipiente areia, água e óleo, veremos que a mistura possui três fases.
Misturas homogêneas: essas misturas apresentam uma única fase. Quando misturamos água e álcool, nem com o auxílio de um microscópico poderíamos ver a separação dos dois líquidos, dizemos então que a mistura possui uma só fase, ou seja, é uma mistura homogênea.
Misturas heterogêneas: são misturas que apresentam mais de uma fase, temos o exemplo da água e do óleo quando se misturam. Seria fácil perceber nesse caso, o aspecto visual heterogêneo - a água se separa completamente do óleo - sendo assim, a mistura se torna heterogênea porque vemos nela duas fases.
Vejamos os exemplos:
1. O leite é uma mistura homogênea quando observamos a olho nu, mas com o auxílio de um microscópico é possível perceber gotículas de gordura em suspensão, e quando aquecemos o leite elas se unem formando a nata.
2. A fumaça que polui o meio ambiente, quando observada ao microscópico mostra minúsculas partículas de carvão suspensas.
3. O granito é formado por quartzo, feldspato e mica, possui três fases, é, portanto, uma mistura heterogênea.

Pedra de granito
Compostos iônicos: definição e características principais
Uma ligação entre íons ocorre com a transferência definitiva de elétrons, essa ligação é caracterizada pela existência de forças de atração eletrostática entre íons. A atração que existe entre íons negativos (ânions) e positivos (cátions) dá origem à ligação iônica.Os compostos formados por ligações iônicas são denominados de compostos iônicos. Para exemplificar, vamos usar a ligação entre Na e Cl, você já sabe qual substância é formada pela junção desses dois elementos? É o sal de cozinha (NaCl), que recebe a denominação científica de cloreto de sódio, a reação que ocorre para a formação você confere agora.
O átomo de sódio (Na) não é estável, pois apresenta 1 elétron livre na camada de valência, a estabilidade só será atingida se ele perder um elétron, o que dará origem ao cátion Na+. O átomo de cloro (Cl-) por sua vez também não é estável, pelos mesmos motivos que o Na, e atingirá a estabilidade somente se ganhar um elétron, esse átomo dá origem ao íon Cl-.
Se os íons já estão formados e eletronicamente estáveis, haverá assim uma interação eletrostática, mais conhecida como ligação iônica. Esse fenômeno químico acontece graças à regra: cargas com sinais opostos se atraem. Veja a equação:
Na+ + Cl- → NaCl
Os compostos derivados da ligação iônica são denominados de compostos iônicos e possuem estrutura eletronicamente neutra.
Características dos compostos iônicos:
- Apresentam ponto de fusão (P.F.) e ponto de ebulição (P.E.) elevados, esta característica é explicada pelo arranjo cristalino destes compostos. O arranjo molecular de uma ligação está tão fortemente ligado que é preciso um intenso aquecimento para quebrar o arranjo do retículo cristalino, portanto, o ponto de ebulição se eleva.
- Os compostos iônicos são condutores de eletricidade, tanto os dissolvidos em água, como também os puros no estado líquido. Há existência de íons nestes compostos e como estes possuem liberdade de movimento são atraídos pelo eletrodo, fechando assim o circuito elétrico.
- Compostos iônicos sólidos à temperatura ambiente apresentam temperatura a 25° C e pressão de 1 atm, e o melhor solvente para esses compostos é a água.
Cuidados com produtos químicos

Produtos de limpeza são tóxicos.
É difícil acreditar, mas em nossa própria casa escondemos um arsenal de produtos perigosos que podem levar à morte, leia abaixo um acidente comum que pode deixar uma pessoa sem um dos sentidos:
Misturar os produtos para limpeza: sabão em pó, amoníaco, água sanitária, e utilizar desta mistura para higienizar ambientes fechados como banheiros é muito comum. No entanto, a reação química proveniente da junção destas substâncias se manifesta com o aparecimento de uma fumaça asfixiante, em poucos instantes ela afeta olhos, nariz, e pode levar à perda do olfato e visão. Viu como é sério? O ambiente fechado não deixa que os vapores tóxicos escapem.
Acompanhe agora algumas dicas importantes:
1. Uma das principais causas dos acidentes domésticos é o uso indevido de produtos de limpeza. Reserve um local exclusivo para produtos perigosos como: água sanitária, limpa-fornos, produtos com amoníaco, álcool, entre outros. O ideal seria um armário com tranca para evitar que crianças toquem nesse material.
2. Utilize equipamentos de segurança quando for manusear produtos tóxicos: avental para proteger o corpo, luvas de borracha para evitar contato com as mãos e óculos de segurança para os olhos, estes são protetores que evitam queimaduras na pele e cegueira.
3. Antes de utilizar um produto químico para limpeza, leia atentamente seu rótulo com as indicações de como usá-lo com segurança.
ATENÇÃO para este símbolo:

Ele diz que o produto é tóxico e pode levar à morte.
4. Outro acidente que ocorre com frequência envolve produtos voláteis como álcool, neste caso o símbolo de alerta é o seguinte:

Se estes procedimentos forem realizados você evitará acidentes e protegerá sua família.
Dióxido de carbono

Gelo seco: dióxido de carbono sólido
Com certeza você já ouviu falar ou até mesmo ingeriu Dióxido de carbono (CO2), mais conhecido como gás carbônico. Quem nunca experimentou um refrigerante e se deliciou por sentir cócegas no céu da boca e com a reação de refrescância provocados pela presença de gás? O CO2 está presente em águas e refrigerantes gaseificados. O sabor ácido característico destas bebidas é alcançado com a adição desse gás.
O dióxido de carbono gasoso pode ser convertido ao estado sólido “CO2 (s)”, com este aspecto é conhecido como gelo seco e ganhou espaço no cinema, onde é usado como efeito especial em filmes de terror e shows de rock. Tudo porque quando o CO2 (s) entra em contato com a pressão atmosférica é aquecido e torna-se um gás, dando origem a uma densa nuvem branca. Essa nuvem permanece ao nível do chão, pois é mais densa que o ar, e assim produz o efeito desejado.
O processo descrito acima é conhecido por Sublimação e consiste na passagem de um sólido ao estado de vapor sem antes passar pelo estado líquido, ou seja, à medida que o gelo-seco é aquecido, ele se transforma diretamente em dióxido de carbono gasoso e não em líquido.
E a utilização de CO2 não para por aí, este gás pode ainda evitar incêndios. Os chamados extintores de dióxido de carbono são indicados para apagar o fogo gerado por equipamentos elétricos energizados, como motores, geradores, cabos, etc. Ao acioná-lo é formada no bocal uma espécie de "neve", esse vapor é o dióxido de carbono líquido em alta pressão.
Mas infelizmente o gás dióxido de carbono tem sua forma perigosa quando presente em nossa atmosfera: é responsável pelo efeito estufa (aquecimento do planeta). O gás prejudicial é lançado pelos automóveis e é proveniente da queima incompleta de combustíveis à base de petróleo.
Elementos naturais e sintéticos
Após investigar a Tabela Periódica pode surgir uma dúvida, todos os elementos dispostos na mesma são encontrados na natureza? Mas se existem todos eles, onde se encontram? Na verdade alguns destes elementos são sintetizados em laboratório, ou seja, produzidos artificialmente.
Elementos naturais: São os elementos químicos encontrados na natureza.
Elementos sintéticos: São os elementos químicos cujos átomos são produzidos artificialmente, é a chamada síntese em laboratório.
A Tabela Periódica conta com 114 elementos distribuídos em linhas e colunas. Entre eles, são conhecidos 92 elementos naturais, sendo o de maior número atômico o urânio (Z = 92), os outros 22 são sintéticos e se classificam em duas categorias:
Cisurânicos: elementos sintéticos que possuem número atômico inferior a 92, por exemplo: Promécio (Pm), Frâncio (Fr).
Transurânicos: elementos com número atômico superior a 92. Exemplos: Plutônio (Pu), Mendelévio (Md), Unúmbio (Uub).
Equação Química
A equação química é a forma de se descrever uma reação química. Os reagentes são mostrados no lado esquerdo da equação e os produtos no lado direito.Representação de uma Equação Química:
Reagentes → Produtos
Através da Equação Química é possível saber o estado físico do átomo participante da reação, através das letras respectivas entre parênteses: Gás (g), Vapor (v), Líquido (l), Solução aquosa (aq), Sólido (s), Cristal (c).
Símbolos podem ser usados para descrever uma reação:
- Catalisadores ou aquecimento: ∆
- Formação de um precipitado: ↓
- Quando a reação é reversível: ↔
- Presença de luz: λ
Números são utilizados para descrever as proporções das diferentes substâncias que entram nas reações, veja a equação:
H2 + Cl2 → 2 HCl
Esse número que antecede o elemento, no caso o número 2, é chamado de coeficiente estequiométrico. A função desse coeficiente é indicar a quantidade de cada substância que participa da reação.
Através de uma equação é possível saber praticamente tudo sobre uma reação química.
Nenhum comentário:
Postar um comentário